ЛЕЧЕНИЕ РАКА ЛЕГКОГО
Основным методом лечения рака легкого, позволяющим надеяться на излечение, до сих пор остается хирургический. Однако показатель опера-бельности составляет от 16 до 20 %, т. е. лишь каждый пятый из впервые выявленных больных подвергается хирургическому вмешательству, а 4 из 5 - консервативным методам лечения.
Не оперируются больные вследствие запущенности процесса (30-40 %), низких функциональных резервов и(или) преклонного возраста (30-40 %) и из-за отказа самого больного от операции. Следовательно, повысить операбельность можно путем своевременной диагностики рака легкого и расширения показаний к хирургическому лечению больных с тяжелой сопутствующей патологией.
Хирургическое лечение
В начале освоения легочной хирургии единственной операцией при раке легкого считалась пневмонэктомия. Однако с накоплением опыта и клинического материала было показано, что лобэктомия при определенных условиях не уступает пневмонэктомии в радикализме, позволяя оперировать больных с более низкими функциональными показателями. В настоящее время достаточно полно освещены подходы к выбору объема операции, определены показания и противопоказания к хирургическому лечению, отработаны методики послеоперационного ведения больных.
Абсолютные онкологические противопоказания к операции на легком при раке: отдаленные метастазы в лимфатические узлы (шейные, подмышечные и др.) или во внутренние органы и ткани (плевра, печень, почки, надпочечники и др.), обширное прорастание опухоли или метастазов в аорту, верхнюю полую вену, диафрагму, поражение противоположного главного бронха, специфический плеврит и др.
Серозная жидкость в плевральной полости, распространение опухоли на перикард, блуждающий и диафрагмальный нервы, иногда на пищевод, грудную клетку, поражение главного бронха, трахеи не являются абсотными противопоказаниями к оперативному вмешательству, поскольку комбинированная операция, иногда в сочетании с лучевой терапией или медикаментозной противоопухолевой терапией, в ряде случаев дает Удовлетворительный результат.
Среди противопоказаний к оперативному вмешательству при раке легкого в настоящее время большое значение придается функциональной Достаточности жизненно важных органов и систем больного (дыхательная, сердечно-сосудистая, мочевыделительная, эндокринная и др.).
Тяжелые осложнения, непосредственно угрожающие больному неизбежной и быстрой смертью (легочное кровотечение, абсцедирование в ателектазе с интоксикацией и др.), нередко побуждают к вмешательству, несмотря на противопоказания. Отказ от операции с чисто онкологических позиций должен быть серьезно мотивирован и должен решаться с обязательным участием хирурга-онколога, имеющего опыт лечения рака легкого.
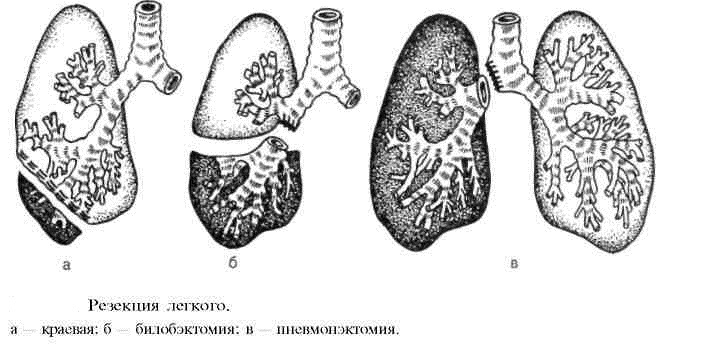
Варианты операций при раке легкого представлены в табл. 9.
Таблица 9
Систематизация
оперативных вмешательств
при злокачественных опухолях
легких
(по А. X. Трахтенбергу, 1994)
(Чиссов В. И. с соавт.,
1995)
|
А. Объем оперативного вмешательства |
|
I. Пневмонэктомия II. Резекция легкого: 1) анатомическая: а) лобэктомия и ее
варианты 2) неанатомическая: а)
клиновидная III. Резекция трахеи и крупных бронхов (без удаления легочной ткани) IV. Эндоскопическая операция и фотодинамическая терапия 1) удаление опухоли
(электро-, лазерное) |
|
Б. Вариант оперативного вмешательства |
|
I. Типичная операция II. Расширенная операция (медиастинальная лимфаденэктомия) III. Комбинированная операция (резекция смежного органа, соседней доли легкого) |
|
В. Характер операции |
|
I. Радикальная II. Паллиативная III. Пробная торакотомия |
При отсутствии противопоказаний объем хирургического вмешательства определяется клинико-анатомической формой роста и степенью распространения опухолевого процесса.
Типичная пневмонэктомия показана при центральном раке с поражением долевых бронхов и промежуточного бронха справа и вовлечением в процесс главного бронха; при периферическом раке со значительным поражением соседней доли; при множественных метастазах в лимфатических узлах нескольких регионарных зон, а также при опухолевой инфильтрации сосудов корня легкого независимо от локализации и характера первичной опухоли (II и III стадии заболевания).
Расширенная пневмонэктомия показана при немелкоклеточном раке легкого T1-2N2MO, при этом вместе с легким удаляется клетчатка с лимфатическими узлами переднего и заднего средостения.
Комбинированная пневмонэктомия показана при врастании опухоли в соседние (перикард, предсердие, пищевод, диафрагма, грудная стенка) органы.
Расширенную и комбинированную пневмонэктомию предпочтительнее выполнять при высокодифференцированных формах рака.
Лобэктомия показана при раке сегментарного или долевого бронха и периферическом раке доли без метастазов или с одиночными метастазами в бронхопульмональные лимфатические узлы.
Лобэктомия с циркулярной или клиновидной резекцией главного бронха показана при локализации опухоли в устье долевого бронха (рис. 29). Бронхопластические лобэктомии составляют в ведущих клиниках до 23 % от числа лобэктомии и 11 % радикальных операций. Убедительно показана возможность сохранения дыхательной паренхимы при таких операциях. Радикализм вмешательства обеспечивается адекватным отдалением линии резекции бронха от опухоли, выполнением клиновидной или окончатой резекции при эндобронхиальных новообразованиях в устьях сегментарных отделов или дистальном отделе долевого бронха и циркулярной резекции при инфильтрации устья долевого бронха.
Экономные резекции легкого (краевая и клиновидная резекции) может выполняться при периферическом раке T1N0M0 у больных с низ- кими Функциональными резервами и(или) в преклонном возрасте.
операции при раке легкого могут быть выполнены из любого операционного доступа: переднебокового, бокового и заднебокового. Каждый из н их имеет свои показания, преимущества и недостатки.
После каждой операции на легких показано дренирование плеврал ьнои полости. Целью дренирования после резекции легкого является удаление воздуха и жидкости из полости плевры, раннее и полное расправление легкого. По вопросу дренирования плевральной полости после пневмонэктомии имеются разные точки зрения. Большинство хирургов дренируют полость плевры в первые часы и дни после операции с целью эвакуации экссудата, контроля объема и темпа кровопотери, оценки герметичности культи главного бронха.
После резекции легкого применяют два дренажа, устанавливаемых в области дна плевральной полости и купола плевры. После пневмонэктомии вводятся один дренаж в VIII межреберье и тонкий катетер во II межреберье для введения антибиотиков и антисептиков (рис. 30).
Обязательным правилом является полное расправление оставшейся части легкого перед ушиванием плевральной полости. Наружная часть дренажей соединяется с банкой Боброва по Бюлау непосредственно в операционной после ушивания раны грудной стенки.
В послеоперационном периоде проводится комплекс лечебных мероприятий, направленных на расправление остатка легкого: ингаляции, положительное давление в конце выдоха (ПДКВ), чрескожная катетеризация трахеи (ЧКТ), санационная бронхоскопия и др. Дренажные трубки удаляются,если по клиническим и рентгенологическим данным легкое хорошо расправлено и нет жидкости в плевральной полости, а также нет поступления воздуха и жидкости по дренажам. Очередность удаления дренажей, в том числе их одновременное удаление, определяется индивидуально.
После продолжительных, травматичных операций по удалению легкого с инфицированием полости плевры дренажи используют для активной Учебной тактики (промывания плевральной полости, введения антибиотиков и антисептических растворов). В первые трое суток послеоперационного периода с целью промывания в тонкий катетер капельно вводится раствор фурацилина с антибиотиками в объеме 2-3 л за 24 часа. Отток промывной жидкости осуществляется пассивно через нижний дренаж. При неосложненном течении после пневмонэктомии дренаж удаляется через сутки при отсутствии клинических, рентгенологических и лабораторных признаков внутриплеврального кровотечения.
После удаления дренажных трубок в ряде случаев плевральные листки продолжают продуцировать экссудат, который нужно систематически удалять путем пункции. Это тем более необходимо, что экссудат не всегда оказывается стерильным и имеется угроза возникновения эмпиемы.
В послеоперационном периоде назначают антибиотики широкого спектра действия (ампициллин, оксациллин, ампиокс, гентамицин, цефало-спорин и др.), сульфаниламидные препараты. Антибиотики можно применять и местно, инфильтрируя ткани по линии операционного разреза, а также вводить через дренаж в плевральную полость. Назначенные с профилактической целью антибиотики нужно отменить через 5 дней, если послеоперационный период не осложнился воспалительным процессом.
В первые послеоперационные дни большое значение приобретает снятие боли из области оперативного вмешательства. Это улучшает жизненные функции, в первую очередь дыхание: оно становится ровным, глубоким, безболезненным.
Послеоперационные осложнения
Осложнения после операций на легких возникают часто и составляют от 20 до 70 % (Харченко В. П., Кузьмин И. В., 1994).
Наиболее тяжелыми и опасными осложнениями хирургического лечения рака легкого являются бронхоплевральные, к которым относятся эмпиема плевры и несостоятельность культи бронха. Бронхиальный свищ, по данным литературы, встречается у 2-12 % больных, причем после пневмонэктомии в 2-4 раза чаще, чем после лобэктомии. Для предупреждения развития этого грозного осложнения рекомендуется сохранять васкуляризацию культи бронха, оставляя ее возможно короче и не травмируя бронх чрезмерным скелетированием. Определенное значение имеет плевр изация культи бронха лоскутом плевры, бронхоперикардиальной фасцией, лоскутом перикарда.
Для профилактики развития бронхиального свища в МНИОИ им. П. А. Герцена разработан и с успехом применяется ручной способ обработки бронха - так называемый бескультевой метод.
Вторым по тяжести осложнением является эмпиема плевральной полости - следствие ее инфицирования, что почти всегда сопутствует бронхиальному свищу. Частота этого осложнения варьирует от 2 до 11 %. Для его профилактики имеют значение рациональная предоперационная подготовка больных, санация бронхиального дерева, асептичность оперативного вмешательства, методика ушивания культи бронха и т. д.
Тяжелым осложнением в послеоперационном периоде является ателектаз оставшейся части оперированного легкого. Клиника его достаточно типична. В результате выключения значительной части легочной ткани возникают резко выраженные одышка, цианоз, тахикардия, повышается температура - свидетельство быстрого инфицирования легочной ткани. Определенные успехи в лечении послеоперационного ателектаза связаны с применением бронхорасширяющих средств (эуфиллин), с использованием бронхоскопии, ЧКТ.
Одной из основных причин смерти больных раком легкого в послеоперационном периоде все еще остается пневмония. Объем поражения легочной ткани отличается большим разнообразием. Воспалительные фокусы бывают разной величины, единичными и множественными, могут иметь также сливной характер, поражающий несколько долей. Послеоперационным пневмониям свойственен высокий лейкоцитоз с нейтрофиль-ным сдвигом лейкоцитарной формулы.
Огромное значение для своевременной диагностики имеет рентгенологическое исследование: диагноз пневмонии часто ставится на основании только рентгенологических данных; клиника появляется позднее. Поэтому ежедневное контрольное рентгенологическое исследование послеоперационных больных должно быть обязательным.
Лечение послеоперационных пневмоний должно быть комплексным. Гуислородотерапия, адекватное обезболивание, средства, стимулирующие функцию сердечно-сосудистой системы, витамины, общеукрепляющая терапия - мероприятия обязательные, но все-таки вспомогательные. 1 лавным оружием врача являются антибиотики, сульфаниламиды и средства, улучшающие дренирующую функцию бронхов.
Внутриплевральное кровотечение может быть симптомом двух осложнений: недостаточного гемостаза и острого нарушения свертываемости крови. Судя по данным литературы, оно встречается в 2-20 % наблюдений.
Диагностика продолжающегося внутриплеврального кровотечения несложна. Наблюдаются выраженная бледность, холодный пот, быстрое ухудшение состояния больного, отсутствие эффекта от проводимого лече ния - гемостатической терапии, переливания крови, сердечных средств. Часто наблюдаются поступление по дренажной трубке из плевральной полости большого количества содержимого, интенсивно окрашенного кровью, с высоким содержанием в нем гемоглобина (более 50 г/л), снижение гемоглобина и гематокрита крови. На рентгенограммах определяется интенсивное тотальное или субтотальное затенение на стороне операции в зависимости от ее объема. В некоторых случаях определяется тень с неровными контурами, сливающаяся с тенью средостения или расположенная пристеночно на фоне жидкости в плевральной полости. Нередко кровотечение в плевральную полость есть, а по трубке отделяемого нет (трубка забилась сгустком крови, фибрина, непроходима вследствие того, что она перегнулась, и т. д.).
При кровотечении в плевральную полость всегда образуется большее или меньшее количество сгустков. Иногда вся излившаяся кровь представляет собой сплошной сгусток - так называемый свернувшийся гемоторакс.
Диагностика свернувшегося гемоторакса основывается главным образом на данных рентгенологического исследования и плевральной пункции. У некоторых больных послеоперационное течение обычно на 3-4-е сутки и позднее осложняется высокой температурой, болями в соответствующей половине груди и нарушением общего самочувствия. Рентгенологически диагностируется массивная тень на стороне операции без смещения средостения в больную сторону в отличие от ателектаза. Иногда на фоне массивного затемнения определяется один или несколько уровней жидкости. При пункции из нескольких точек удается эвакуировать не больше 10-30 мл темной крови или сукровичной жидкости при сохранении массивного затемнения легочного поля при контрольной рентгеноскопии после пункции.
Показаниями для реторакотомии после операций на легких являются:
Внутриплевральное кровотечение;
Свернувшийся гемоторакс;
Несостоятельность культи бронха.
Острая сердечно-сосудистая и легочная недостаточность также занимает одно из ведущих мест среди осложнений, возникающих после операций по поводу рака легкого. Частота этих осложнений находится в прямой зависимости от тяжести операции, кровопотери и компенсаторных возможностей сердечно-сосудистой системы. Чаще они наблюдаются после расширенных и комбинированных пневмонэктомий и обычно у больных пожилого возраста. К предрасполагающим факторам относятся со путствующие заболевания: гипертоническая болезнь, атеросклероз, ишемическая болезнь сердца, пневмосклероз, эмфизема легких и др.
Тромбоэмболия легочной артерии и сосудов головного мозга, часто приводящая к летальному исходу, относится к самым опасным осложнениям в хирургии рака легкого. Профилактика тромбоэмболических осложнений проводится как до операции, так и в послеоперационном периоде. Хорошо зарекомендовали себя трентал, курантил, аспирин, реопо-лиглюкин, гепаринотерапия.
Нарушение сердечного ритма (синусовая тахикардия, предсердная и желудочковая экстрасистолия, реже мерцание и трепетание предсердий) возникает чаще в 1-2-е сутки после операции, особенно у больных с указаниями в анамнезе на приступы мерцательной аритмии. К инфаркту миокарда предрасположены больные ишемической болезнью сердца, особенно ранее перенесшие это осложнение. На фоне мониторинга ЭКГ таким больным необходимо проводить интенсивную сердечно-сосудистую терапию с включением антиаритмических средств, антикоагулянтов и антиагрегантов.
Пристальное внимание хирурга должны привлекать даже незначительные воспалительные явления в области послеоперационной раны. При появлении ограниченной инфильтрации, болезненности, покраснения кожи в области шва необходимо снять этот шов, осторожно развести на небольшом участке кожи, дренировать подкожную клетчатку резиновой полоской.
Послеоперационная летальность является основным показателем в оценке непосредственных результатов хирургического лечения рака легкого. По материалам МНИОИ им. П. А. Герцена, послеоперационная летальность в последние годы снизилась и составила 3,8 %. Совершенствование оперативной техники, функциональной диагностики, анестезиологии и интенсивной терапии, улучшение предоперационной подготовки и послеоперационного ведения больных способствуют ее снижению.
Продолжительность жизни является вторым основным критерием эффективности хирургического лечения больных раком легкого. Пятилетняя выживаемость составляет в среднем 30 % и не имеет заметной тенденции к повышению (Трахтенберг А. X., 1987). По его данным, после радикальных операций по поводу рака легкого I стадии более 5 лет жили 61,4 % больных, II стадии - 43,5 %, III стадии - 19,6 % больных. Таким образом, 5-летняя выживаемость больных раком легкого I стадии в 1,5 раза выше, чем II стадии, и в 3 раза больше, чем III стадии заболевания.
Основными факторами прогноза при хирургическом лечении больных раком легкого являются распространенность опухолевого процесса (стадия заболевания, наличие метастазов в регионарных лимфатических узлах), гистологическая структура опухоли и степень анаплазии опухолевых клеток.
Комбинированное и комплексное лечение
Малоудовлетворительные результаты только хирургического лечения рака легкого обусловлены прежде всего трудностями определения истинной распространенности опухоли до и во время операции. Кроме того, происходит диссеминация (рассеивание) опухолевых клеток по лимфатическим и кровеносным путям во время вмешательства, что также способствует формированию отдаленных метастазов. С целью решения указанных проблем был предложен и активно развивается комбинированный метод лечения.
Теоретические предпосылки сочетанного воздействия двух локальных методов - лучевого и хирургического - состоят в том, что у половины радикально оперированных больных прогрессирование болезни в первые 2 года определяется ее внутригрудным рецидивом (в основном метастазами в лимфатические узлы средостения).
Лучевая терапия противопоказана при активном туберкулезе, некомпенсированном сахарном диабете, сердечно-легочной недостаточности III степени, анемии, лейкопении (количество лейкоцитов менее ЗхЮ^/л), общем ослабленном состоянии больного.
Основная цель предоперационного лучевого воздействия - добиться летальных и сублетальных повреждений наиболее анаплазированных раковых клеток в первичной опухоли, кровеносных и лимфатических структурах средостения. С радиобиологических позиций альтернативой классическому облучению является интенсивно-концентрированный режим. За короткий срок (4-5 дней) подводят к опухоли и средостению разовую дозу 5 Гр, суммарная доза 20-25 Гр. При этом не ухудшаются условия проведения операции, так как постлучевые изменения не успевают развиться.
Кроме того, используются предоперационная лучевая терапия средними фракциями (РОД 3 Гр, СОД 36 Гр) и крупноочаговое облучение однократной очаговой дозой 7,5-10 Гр.
Облучение проводят на гамматерапевтических установках типа «Агат», «Рокус» либо на линейных или циклических ускорителях с использованием тормозного излучения.
В объем облучения включают первичную опухоль и зоны регионального лимфатического коллектора: бронхопульмональные, корня легкого на стороне поражения, трахеобронхиальные и бифуркационные, паратра-хеальные узлы с обеих сторон до уровня яремной вырезки.
Границы полей облучения зависят от локализации опухоли, ее размеров и состояния лимфатических узлов. Верхняя граница соответствует нижнему краю ключицы; граница поля на стороне, противоположной поражению, проходит на 1,5 см латеральное края трахеи; нижняя граница (по средней линии тела) - на расстоянии 4-5 см от нижнего края бифуркации трахеи. При локализации опухоли в верхней доле нижняя граница поля облучения на уровне корня пораженного легкого ограничена устьями сегментарных бронхов нижней доли. При локализации опухоли в нижней или средней доле верхняя граница поля облучения на уровне корня пораженного легкого ограничена устьем сегментарных бронхов верхней доли.
При периферической форме рака легкого в случае значительной проекционной удаленности опухолевого узла от корня легкого облучение проводят двумя объемами (два противолежащих поля на верхний очаг и два - на зону регионарного метастазирования); «дорожку» к корню легкого включают в один из облучаемых объемов.
Границы полей облучения как при центральном, так и при периферическом раке легкого должны находиться на расстоянии 2-3 см от рентгенологически видимых краев опухоли (рис. 31-32).
Показанием для проведения послеоперационной лучевой терапии является обнаружение метастаза, по крайней мере в одном лимфатическом узле - бронхопульмональном, корня легкого или средостения.
Основная идея послеоперационной лучевой терапии состоит в подавлении жизнеспособности клеток в лимфатических сосудах и узлах, полное (радикальное) удаление которых невозможно проконтролировать.
Дополнительными противопоказаниями к послеоперационной лучевой терапии являются осложнения операции (бронхиальный свищ, эмпиема плевры и др.). Интервал между операцией и послеоперационной лучевой терапией 3-4 недели. Объем облучения аналогичен предоперационно-^У, за исключением части удаленного легкого.
Лучевая терапия может быть проведена по следующим методикам:
Разовая доза (РОД) 2 Гр ежедневно 5 раз в неделю до суммарной дозы (СОД) 60 Гр либо РОД 3 Гр ежедневно 5 раз в неделю до СОД 45 Гр. 1 1ри проведении послеоперационной лучевой терапии больным, которым
было проведено предоперационное лучевое воздействие, облучение проводят по методике: РОД 2 Гр ежедневно 5 раз в неделю до СОД 45 Гр.
Улучшения отдаленных результатов комбинированного лечения удается добиться при III стадии и при поражении метастазами внутригруд-ных лимфатических узлов, особенно при плоскоклеточном раке. При аде-нокарциноме лучевая терапия существенно не влияет на этот показатель.
Лучевая терапия рака легкого может сопровождаться местными и общими лучевыми реакциями, а также осложнениями. К симптомам общей лучевой реакции относят нарастающую слабость, снижение аппетита, нарушение сна, лейко- и тромбоцитопению, анемию, расстройства сердечно-сосудистой деятельности. Для профилактики лучевой реакции целесообразно назначать аскорбиновую кислоту, антигистаминные препараты, кортикостероиды, лекарственные средства, активирующие деятельность сердечно-сосудистой и дыхательной систем.
Химиотерапию как компонент комплексного лечения применяют в пред- и послеоперационном периодах. Эффективность химиотерапии рака легкого в значительной степени зависит от гистологической структу ры опухоли: немелкоклеточный рак (плоскоклеточный и железистый) отличается малой чувствительностью к химиопрепаратам, тогда как при мелкоклеточном раке химиотерапия достаточно эффективна.
Химиотерапия больных раком легкого противопоказана при истощении больного; выраженной опухолевой или гнойной интоксикации;
распаде опухоли, сопровождающемся значительным кровохарканьем, при котором существует опасность возникновения легочного кровотечения; выраженных патологических изменениях печени, почек, сердечнососудистой системы; низких показателях содержания в крови лейкоцитов (менее Зх10 в 9 степени/л), тромбоцитов (менее 12х10 в 9 степени/л), эритроцитов (менее Зх10 в 12 степени/л).
В клинической практике для лечения рака легкого с определенным успехом применяют несколько противоопухолевых препаратов: циклофосфан, винкристин, метотрексат, фосфамид, этопозид, цисплатин, митоми-Цин, адриамицин, нитрозометилмочевина и др.
Химиотерапия при мелкоклеточном раке легкого составляет основу лечения и проводится по схемам АСЕ (адриамицин, циклофосфан, этопозид), САМ (циклофосфан, адриамицин, метотрексат), CAV (цикло фосфан, адриамицин, винкристин), CMC-VAP (циклофосфан, мето-трексат, циклогексилнитрозомочевина, винкристин, адриамицин, прокарбазин).
При операбельных формах МРЛ (I-II стадии) хирургическое лечение дополняется послеоперационной химиотерапией (не менее 4 курсов), при неоперабельных (III стадия) формах многокурсовая интенсивная химиотерапия используется в сочетании с лучевой терапией на очаг, корень легкого и средостение.
В литературе имеются сведения, доказывающие возможность иммунопрофилактики рецидива заболевания у больных раком легкого после радикальных хирургических операций. Так, по данным Аусекар Б. В. с соавт. (1985), выживаемость больных МРЛ, получавших тактивин, составила 113 недель по сравнению с 75 неделями у больных контрольной группы.
Многие авторы подчеркивают важность определения показаний и противопоказаний к иммунотерапии, динамического иммунологического контроля в процессе лечения. Иммунотерапию рассматривают как один из дополнительных методов комплексного лечения больных раком легкого.
Наблюдение за больными, выписанными из стационара по окончании лечения, осуществляют путем контрольного обследования в онкодиспан-сере в течение первого года через 3 месяца, второго-третьего - дважды в год и с четвертого года наблюдения - 1 раз в год. Контроль за излеченным больным раком легкого предусматривает проведение клинических и специальных методов исследования, оценку результатов лечения, диагностику поздних осложнений и прогрессирования заболевания.
При контрольном обследовании больных выполняют рентгенографию легких, фибробронхоскопию; по показаниям - УЗИ печени, сцинтиграфию головного мозга, скелета и другие специальные методы исследования.
Была проведена в 1910 г. в целях рассечения плевральных спаек. Однако вследствие ограниченности инструментария и плохой визуализации использование этого метода вызывало мало энтузиазма у клиницистов в течение последующих 80 лет. После внедрения надежной видеотехнологии в конце 1980-х гг. торакоскопия (или видеоассистированная торакальная хирургия) стала весьма важным методом для диагностики и лечения многих заболеваний в общей торакальной хирургии. В этой статье описаны видеоторакоскопическая клиновидная резекция узлового образования легкого неясной этиологии и заключительная торакоскопическая лобэктомия по поводу рака.
АНАТОМИЯ
Анатомия легкого определяется ветвлением каждого бронха. В каждую долю входят ветви долевых бронхов. Легочная артерия разделяется слева от восходящего отдела аорты. Правая ветвь проходит за восходящим отделом аорты, а левая идет вдоль вогнутости дуги аорты. В воротах каждая легочная артерия дает крупную первую ветвь или передний ствол, который снабжает кровью один или более сегментов верхней доли. Дальнейшее ветвление происходит параллельно ветвлению бронхиального дерева.
Легочные вены отходят от сплетений легочных капилляров в альвеолах. Венулы проходят в интерлобарных пространствах и образуют стволы легочных вен. От каждого легкого отходят два основных ствола (один от верхнего и один от нижнего отдела), которые впадают в левое предсердие по задней поверхности. Бронхиальные артерии снабжают кровью паренхиму легких и начинаются непосредственно от аорты. Левое легкое состоит из двух долей, разделенных косой (большой) фиссурой. Детальное знание топических признаков легких и их взаимоотношений с рядом лежащими анатомическими образованиями необходимо для применения торакоскопии по поводу резекции легкого. Их может быть от 1 до 3, и они сопровождают бронхиолы, идущие к легочным долькам. Ниже корня легкого расположены легочные связки, которые образованы двумя слоями плевры, формирующими отдельные связки, которые прикрепляются начиная от нижнего края перикарда до нижней части медиастинальной поверхности плевры.
ТАКТИКА ЛЕЧЕНИЯ ПРИ ОДИНОЧНОМ УЗЛОВОМ ОБРАЗОВАНИИ ЛЕГКОГО
Дифференциальная диагностика одиночного узлового образования легкого, случайно обнаруженного при обзорной рентгенографии легких — большинство узлов имеют доброкачественную природу. Только 5% из них в итоге оказываются злокачественными. Однако если показаниями к резекции служат крупный размер и быстрый рост, примерно 40% резецированных узлов будут иметь злокачественную природу. Именно поэтому решение провести биопсию или резекцию легочного узла имеет решающее значение.
Пациенту с впервые выявленным узловым образованием легкого необходимо провести тщательный сбор анамнеза и физикальное обследование, уделяя особое внимание наличию в анамнезе курения, контакта с химикатами, асбестом или работе в угледобывающей промышленности. Кроме того, необходимо отметить следующие симптомы: одышку, боли в грудной клетке, кашель, кровь в мокроте или потерю массы тела. При физикальном обследовании обязательно нужно оценить наличие шейной, надключичной или подмышечной лимфаденопатии и провести тщательную аускультацию всех легочных полей.
Следует просмотреть результаты всех когда-либо проведенных визуальных исследований, обращая внимание на свежие и ранее проведенные рентгенографические исследования легких, которые могут сразу же дать требуемую диагностическую и прогностическую информацию. Размер, скорость роста и внешний вид узла могут позволить предположить его злокачественную или доброкачественную природу. Например, одиночное узловое образование легкого размером менее З см, рентгенографически неизменное в течение 2 лет наблюдения, может считаться доброкачественным и не требующим дальнейшей диагностической оценки. Помимо этого, такие рентгенологические признаки, как ровный контур, диффузная кальцификация или кальцификация в виде зерен попкорна, свидетельствуют о доброкачественной природе опухоли. Однако образование более 3 см в диаметре, независимо от других признаков или скорости роста, обычно является злокачественным.
Если полученные клинические и рентгенологические данные кажутся неопределенными или есть подозрение на злокачественную опухоль, необходима дальнейшая диагностическая оценка. Ее нужно начать с КТ грудной клетки, печени и надпочечников. При отдаленных метастазах, выраженной аденопатии средостения, поражении трахеи, опухоли бронха или лимфаденопатии с противоположной стороны рак считается неоперабельным и обычно смертельным.
При отсутствии неоперабельного заболевания необходимо провести биопсию всех узловых образований легких при подозрении на их злокачественную природу. Предоперационная диагностика должна включать бронхоскопию для выявления эндобронхиального распространения опухоли или компрессии бронхов извне, которые могут оказывать влияние на функции легких. КТ грудной клетки и надпочечников с внутривенным контрастированием позволяет точно определить расположение и размеры узлового образования легкого, диагностировать лимфаденопатию средостения или корней легких, установить наличие заболевания на противоположной стороне или исключить отдаленные метастазы. Если при сборе анамнеза или физикальном обследовании обнаружена какая-либо нейрогенная патология, необходимо назначить КТ головы. Радиоизотопное исследование костей следует проводить, только когда имеются симптомы, признаки или лабораторные данные, свидетельствующие о возможном опухолевом поражении костей. После завершения обследования необходимо провести тестирование функций легких для определения легочного резерва, необходимого для осуществления клиновидной резекции, лобэктомии и, возможно, пневмонэктомии. Пациенты с объемом форсированного выдоха за 1 с менее 60% должного не подходят для пневмонэктомии. У пациентов с ОФВ 1 и диффузионной емкостью легкого для диоксида углерода менее 40% должного отмечается повышение уровня послеоперационных осложнений и смертности после лобэктомии, хотя отдельные пациенты все-таки могут стать кандидатами для резекции. Однако торакоскопическая клиновидная резекция может быть безопасно проведена у пациентов с ОФВ 1 не более 25% должного.
Все пациенты, которым показана открытая биопсия легких, могут быть кандидатами для видеоторакоскопии. Клиновидная резекция легкого с помощью видеоторакоскопии имеет несколько преимуществ перед обычной торакотомией. К ним относятся: улучшенная визуализация, снижение интенсивности послеоперационных болей и минимальные косметические дефекты, а также потенциальное снижение продолжительности госпитализации и раннее возвращение к трудовой деятельности. Наиболее значительным недостатком торакоскопии, по сравнению с торакотомией при резекции легкого, остается потеря тактильной обратной связи у .
Торакоскопическую клиновидную резекцию можно провести у большинства пациентов с некальцифицированными узлами диаметром менее 3 см. Торакоскопическую резекцию образований, расположенных в области наружной трети легкого, достаточно легко осуществить с меньшим риском повреждения сегментарных сосудов или бронхов. При определении местоположения узла в значительной степени помогает КТ, которая в общем оказалась единственным необходимым методом для определения локализации образования. Если патологическое исследование замороженных срезов подтверждает злокачественную природу образования, необходимо провести лобэктомию с помощью видеоторакоскопии или открытой торакотомии. Лобэктомия требуется даже в случае маленькой опухоли в стадии Т1 . Эту возможность необходимо детально обсудить с пациентом перед . Группа по исследованию рака легких (The Lung Cancer Study Group) в рандомизированном исследовании сравнила результаты клиновидной резекции и лобэктомии при опухолях T1N 0 и установила повышенную частоту возникновения местных рецидивов в группе с меньшим объемом резекции. Клиновидная резекция может стать приемлемым компромиссом только для пациентов, которые не в состоянии перенести более обширную операцию вследствие ограниченного легочного резерва.
ТЕХНИКА ТОРАКОСКОПИЧЕСКОЙ РЕЗЕКЦИИ ЛЕГКОГО
После укладки пациента в латеральное положение и правильного введения двухпросветной эндотрахеальной трубки соответствующее легкое необходимо исключить из механической вентиляции, пока хирурги обрабатывают руки. Этого времени достаточно для полного спадения легкого. Инсуффляция при видеоторакоскопии нужна редко. Если декомпрессия легкого оказалась неадекватной, для установки инструментов можно применить инсуффляцию. В таких случаях давление инсуффляции должно быть ограничено 10 мм рт.ст., и при этом необходимо отслеживать признаки ухудшения венозного возврата и снижения сердечного выброса. Расположение хирурга и ассистента/ассистентов соответствуют таковому при открытой торакотомии. Видеомониторы расположены на прямой линии, проведенной между оператором и мишенью оперативного лечения. В случае образований верхних отделов легкого мониторы находятся обычно по обе стороны от головного конца стола, а при образованиях нижней части легкого - по обе стороны от ножного конца стола. Видеоторакоскопия обеспечивает обзор анатомии грудной клетки через маленькое, увеличенное поле зрения. Таким образом, весьма важно ориентировать операционное поле, как это видно на дисплее. Два поля зрения, рекомендуемые при видеоторакоскопии, получают путем введения оптики через задний или нижний порт. При обзоре через задний порт анатомия грудной клетки может быть ориентирована аналогично тому, как видит это хирург при открытой торакотомии. При левосторонней торакоскопии с использованием стандартного видеомонитора образования, расположенные спереди, оказываются сверху, задние образования находятся сзади, нижние - слева, а верхние - справа. Для лучшего обзора апикальных образований грудной клетки видеоторакоскоп может быть введен через порт, расположенный снизу, по срединно-подмышечной линии. При такой ориентации апикальные образования оказываются в верхней части экрана, нижние - сзади, передние структуры - слева, а задние - справа.
Большинство хирургов используют 3 или 4 троакара, хотя лобэктомию обычно можно провести с помощью только двух разрезов. Первый разрез, для 10-миллиметрового первичного троакара, необходим преимущественно для торакоскопа, его устанавливают в седьмом и восьмом межреберном промежутке по средней подмышечной линии. Второй разрез - для переднего доступа (длиной 4,5-6 см) - нужен для диссекции и извлечения препарата, его делают в пятом или шестом межреберье, сразу же ниже молочной железы или большой грудной мышцы. Расположение этого разреза выбирают для диссекции в области корня, в более широком межреберном промежутке, обычно независимо от того, планируют верхнюю или нижнюю лобэктомию. Можно применять дополительные разрезы - в области подмышечной впадины или кзади от нее - для улучшения визуализации или обеспечения ретракции.
Первичный торакоскопический осмотр. После того как сделан второй разрез, хирург проводит торакоскопическую ревизию, которая включает подтверждение расположения опухоли, исключение или подтверждение наличия плевральных метастазов и рассечение легочной связки. Поверхность легких необходимо тщательно исследовать, чтобы исключить их повреждение троакарами либо выявить выпуклости или впадения на висцеральной плевре, которые точно могут указать на локализацию легочной патологии. Необходимо уделить дополнительное время обследованию средостения на наличие патологических лимфатических узлов. Дополнительные порты вводят трансторакально под визуальным контролем. Успешной установке портов в виде бейсбольного ромба способствует пальпация наружной поверхности грудной клетки относительно образования, подлежащего удалению. Места разрезов выбирают таким образом, чтобы они не мешали друг другу, обеспечивая адекватную визуализацию ворот. Необходимо отметить, что степлер лучше вводить в тот разрез, который обеспечивает лучший угол со структурами ворот. Выбор инструментов для торакоскопической лобэктомии весьма важен для успешного проведения операции. Необходимо использовать 30-градусный торакоскоп, чтобы панорамная визуализация во время диссекции была оптимальной и используемые инструменты как можно меньше мешали друг другу. Для диссекции можно применять ряд инструментов, включая обычные инструменты и специальные для торакоскопии и лапароскопии. Особенно помогает при ретракции и диссекции использование длинных изогнутых инструментов, так как это позволяет свести к минимуму помехи и столкновения их друг с другом. Торакоскопические (линейные) механические степлеры, к примеру «EndoGIA» (US Surgical, Norwalk, CT), используют для пересечения сосудов (2- или 2,5-миллиметровые степлеры), бронхов (3,5- или 4,8-миллиметровые степлеры) и фиссуры. После приведения степлера в действие бранши инструмента открывают и осматривают линию скобок, чтобы убедиться, что скобки легли правильно, нет кровотечения и утечки воздуха. Часто для резекции одного образования необходимо несколько раз перезаряжать степлер. После каждого прошивания следует менять положение удаляемого препарата, чтобы легочная ткань входила в бранши степлера без помех. После обнаружения узла в легком для его резекции применяют эндоскопический степлер. В большинстве случаев пораженный участок можно захватить такими инструментами, как окончатый зажим, зажим Бэбкока или легочный зажим, чтобы сформировать выпирающий край легкого для наложения степлера. Если узел расположен на плоской поверхности, на которую невозможно наложить бранши эндоскопического степлера, для создания выпирающего края легочной ткани можно использовать лазер. Препарат помещают в защитный контейнер. Для того чтобы свести к минимуму возможность местной контаминации мест введения троакаров клетками вероятно имеющейся раковой опухоли, препарат перед извлечением из грудной клетки необходимо изолировать с помощью эндоскопического контейнера.
Диссекция в воротах легкого (легочная вена). После того как исследование замороженных срезов подтвердило диагноз злокачественной опухоли, может быть проведена лобэктомия. В то время как большинство хирургов при открытой лобэктомии сначала проводят диссекцию фиссуры для получения доступа к артериальным ветвям, торакоскопическую лобэктомию полностью осуществляют в области ворот, и диссекцию фиссуры не проводят до тех пор, пока не пересекут все структуры, расположенные в воротах. Диссекцию ворот проводят через разрез для первичного доступа в целях визуализации и мобилизации структур, находящихся в воротах. При любой анатомической торакоскопической лобэктомии диссекцию ворот начинают с мобилизации легочной вены, диссекции способствует тракция легкого кзади и книзу. Перемещение торакоскопа в передний разрез может улучшить визуализацию верхней части ворот или способствовать наложению линейного степлера для верхней лобэктомии, если торакоскоп введен через подмышечный порт. Легкое отводят кзади, находят и мобилизуют верхнюю легочную вену, затем обходят левую верхнюю легочную вену с помощью изогнутого зажима. Диссекция за верхней легочной веной позволяет обнаружить легочную артерию. Далее накладывают степлер и пересекают верхнюю легочную вену, обнажая легочную артерию. Диссекция в воротах легкого (легочная артерия). После этого мобилизуют апикальную и переднюю ветви левой легочной артерии; этот прием облегчается диссекцией лимфатического узла, который находится в области передней поверхности верхнедолевого бронха. Эти ветви затем пересекают с помощью степлера. Сейчас можно увидеть и пересечь степлером заднюю артерию, если она не включена в апикально-передний ствол. Диссекция в воротах (бронх). На данном этапе можно увидеть левый верхнедолевой бронх и пересечь его степлером. Если бронх расположен кпереди от апикальной и передней артерий, сначала завершают работу с бронхом. Далее степлер накладывают на язычные ветви. В заключение завершают мобилизацию доли по фиссуре и извлекают препарат. Установка в плевральную полость. После удаления препарата грудную клетку необходимо еще раз внимательно осмотреть с помощью видеокамеры. Грудную полость следует частично заполнить 0,9% раствором натрия хлорида и раздуть легкое для проверки линии швов на герметичность и наличие кровотечения. Затем вводят плевральный дренаж через самый нижний из портов, направляют его в сторону верхушки под визуальным контролем и соединяют с вакуумным устройством с разряжением 20 см вод.ст. после зашивания мест введения троакаров.
РЕЗУЛЬТАТЫ ТОРАКОСКОПИЧЕСКОЙ РЕЗЕКЦИИ ЛЕГКОГО
В среднем частота конверсии: в открытую торакотомию при обширных резекциях легких варьирует от 1,8 до 23% .
В ранний период применения этого метода всем пациентам после видеоторакоскопической клиновидной резекции для проведения обширной резекции при выявлении рака в результате исследования замороженных срезов требовалась конверсия в открытую операцию. На сегодняшний день в центрах с большим опытом выполнения этих операций конверсия требуется реже.
Торакоскопическая клиновидная резекция имеет 100% чувствительность и специфичность при диагностике рака и характеризуется минимальной частотой послеоперационных осложнений. К наиболее распространенным осложнениям относятся длительная утечка воздуха, ателектаз, пневмония и предсердные . Каждое из осложнений отмечается менее чем у 2% пациентов. Продолжительность госпитализации после видеоторакоскопической клиновидной резекции варьирует от 2 до 5 дней.
После постановки диагноза рака легких в результате исследования замороженных срезов необходимо провести радикальную операцию. Показания к торакоскопической лобэктомии аналогичны показаниям к открытой лобэктомии. Она рекомендована пациентам с доказанным или подозреваемым раком легкого (клиническая стадия I), которым рекомендована радикальная резекция посредством лобэктомии. Абсолютные противопоказания к лапароскопической лобэктомии - невозможность проведения полной резекции путем лобэктомии опухоли в стадии Т 3 , а также отсутствие возможности проведения отдельной вентиляции противоположного легкого. Относительными противопоказаниями считают опухоль, видимую при бронхоскопии, и наличие лимфаденопатии доброкачественной или злокачественной природы в воротах легких, которая может осложнить диссекцию сосудов.
Были доказаны безопасность и эффективность торакоскопической лобэктомии у пациентов с ранней стадией рака легких. Опубликовано достаточное количество исследований (как одно-, так и многоцентровых), чтобы сделать заключение о том, что торакоскопическая лобэктомия - приемлемый метод лечения пациентов с I клинической стадией рака легких.
Daniels et al. сообщили о результатах торакоскопической лобэктомии у 110 пациентов. Тридцатидневная летальность составила 3,6%, интраоперационной смертности не зафиксировано. Частота конверсий составляла 1,8%, ни одна из конверсий не была экстренной. Средняя продолжительность плевральной полости - 3 дня, средняя продолжительность госпитализации тоже составила 3 дня. Группа по раку и лейкемии (Cancer and Leukemia Group В) сообщила о результатах многоцентрового исследования 97 пациентов, подвергшихся торакоскопической лобэктомии. В этой серии смертность находилась в пределах 2%, время операции - 130 мин, а средняя продолжительность госпитализации составила 3 дня. Было опубликовано множество других серий исследований, и в качестве резюме можно сказать, что исходы торакоскопической лобэктомии оказались эквивалентными опубликованным результатам торакотомии и лобэктомии по показателям безопасности и онкологической эффективности, которые измерялись частотой проведения полной резекции, временем операции, объемом лимфодиссекции, интраоперационной летальностью и выживаемостью в раннем периоде. К признанным преимуществам торакоскопической анатомической резекции относятся меньшая выраженность послеоперационных болей, меньшая продолжительность операции и сохраненные функции легких.
Ростов-на-Дону
Резекция легкого в Ростове-на-Дону: доктора медицинских наук, кандидаты медицинских наук, академики, профессора, член-корреспонденты академии. Запись на прием, консультирование, отзывы, цены, адреса, подробная информация. Запишитесь к ведущему хирургу г. Ростова-на-Дону без очереди в удобное для Вас время.
Сергостьянц Геннадий Завенович
Сергостьянц Геннадий Завенович, Профессор , Доктор Медицинских наук, Заслуженный врач РФ, Заведующий торакальным отделением Ростовского Онкологического Института, Врач-торакальный хирург высшей квалификационной категории
Полозюков Илларион Александрович
Полозюков Илларион Александрович , Заведующий отделением торакальной хирургии Областной специализированной туберкулезной больницы, Врач-торакальный хирург высшей квалификационной категории
 Автор статьи: Низолин Дмитрий Владимирович.
Автор статьи: Низолин Дмитрий Владимирович.
Что такое Резекция легкого?
Данный вид хирургического вмешательства заключается в том, что происходит удаление части легочной паренхимы. Легочная ткань устроена таким образом, что потеря части легочной паренхимы не приведет, однако, к нарушению выполнения главной функции – газообмена. Как правило, происходит уменьшение площади, способной к газообмену.
Необходимо отметить, что резекция – органосохраняющая операция, направленная на удаление той части органа, которая подвержена тому или иному патологическому процессу.
Существует два вида резекции легкого:
- Анатомическая (типичная резекция легкого) подразумевает удаление обособленного анатомическими границами образование. (удаление доли, удаление одного или нескольких сегментов: сегментэктомия, билобэктомия, лобэктомия или полисегментарная резекция.
- Атипичная (краевая) резекция легкого. Данное хирургическое вмешательство подразумевает удаление части органа при максимальном сохранении здоровой части легкого без учета анатомических границ.
Показания к проведению краевой резекции легкого :
— Доброкачественные новообразования
— Пневмосклероз
— Туберкулез
— Диссеминированные процессы неясной этиологии
Показания к резекции легкого:
— Рак легких (наиболее распространенное из заболеваний, при которых показана резекция легких)
— Эмфизема легких (расширение дистальных бронхиол)
— Бронхоэктаз (расширения бронхов)
— Туберкулез
— Буллезная эмфизема
— Некроз легкого, абсцессы, гангрена
— Травматические повреждения легочной паренхимы
— Кистоз
Подготовка к операции
Перед операцией проводят ряд важных исследований, имеющих диагностическое значение. Например:
— УЗИ (ультразвуковое исследование)
— Рентгенологический метод исследования
— Позитронно-эмиссионная томография
— Исследование дыхательных функций, экскурсии грудной клетки
— Перкуссия, аускультация
В случае если показанием для данного рода хирургического вмешательства является злокачественное новообразование возможно проведение в предоперационном периоде химиотерапии и лучевой терапии.
Возможно также лечение антибиотиками.
Проведение операции резекции легкого
Данный вид хирургического вмешательства производится под общим видом обезболивания. Используется интубационный эдотрахеальный наркоз.
Для обеспечения доступа к органу производится торакотомия. Производится рассечение тканей в межреберном промежутке. В дальнейшем используется хирургический ретрактор.
После обнаружения сегментарного бронха, производят его сдавление мягкими зажимами. После проведения раздувания легкого, определяют спавшийся сегмент. В дальнейшем производят пересечение соответствующих вен и артерий. При обнаружении очага патологического процесса за пределами выделенного сегмента, производят удаление и субсегмента.
Возможно установление дренажа.
В последнее время широкое распространение получил метод мини-инвазии.
Восстановительный период
Основные задачи восстановительного периода следующие:
— обеспечение проходимости воздухоносных путей
— профилактика плеврита
— профилактика образования полостей
— профилактика образования свищей
— профилактика воспаления легочной паренхимы
Возможные осложнения данного хирургического вмешательства :
— Кровотечение
— Пневмония (воспаление легких)
— Ателектаз
— Дыхательная недостаточность
— Сердечная недостаточность
Запись на прием к хирургу
Уважаемые пациенты, Мы предоставляем возможность записаться напрямую на прием к доктору, к которому вы хотите попасть на консультацию. Позвоните по номеру,указанному вверху сайта, вы получите ответы на все вопросы. Предварительно, рекомендуем Вам изучить раздел .
Как записаться на консультацию врача?
1) Позвонить по номеру 8-863-322-03-16 .
1.1) Или воспользуйтесь звонком с сайта:
Заказать звонок
Позвонить врачу
1.2) Или воспользуйтесь контактной формой.