Το οξείδιο του αργύρου διαλύεται για να σχηματίσει μια σύνθετη ένωση - διαμίνη υδροξείδιο αργύρου (Ι) ΟΗ
όταν προστίθεται μια αλδεΰδη στην οποία συμβαίνει μια αντίδραση οξείδωσης-αναγωγής για να σχηματιστεί μεταλλικός άργυρος:
Εάν η αντίδραση διεξάγεται σε δοχείο με καθαρά και λεία τοιχώματα, τότε ο άργυρος καθιζάνει με τη μορφή λεπτής μεμβράνης, σχηματίζοντας μια επιφάνεια καθρέφτη. Με την παρουσία της παραμικρής μόλυνσης, ο άργυρος απελευθερώνεται με τη μορφή ενός γκρίζου χαλαρού ιζήματος.
Η αντίδραση «ασημένιος καθρέφτης» μπορεί να χρησιμοποιηθεί ως ποιοτική αντίδραση για τις αλδεΰδες. Έτσι, η αντίδραση «ασημένιος καθρέφτης» μπορεί να χρησιμοποιηθεί για τη διάκριση μεταξύ γλυκόζης και φρουκτόζης. Η γλυκόζη είναι μια αλδόζη (περιέχει μια ομάδα αλδεΰδης σε ανοιχτή μορφή) και η φρουκτόζη είναι μια κετόζη (περιέχει μια κετο ομάδα σε ανοιχτή μορφή). Επομένως, η γλυκόζη δίνει έναν «ασημένιο καθρέφτη» αντίδραση, αλλά η φρουκτόζη όχι.
Βιβλιογραφία
- Nekrasov B.V.Βασικές αρχές της γενικής χημείας. - 3η έκδ., αναθ. και επιπλέον - M.: “Chemistry”, 1973. - T. 2. - 688 p.
- Nesmeyanov A. N., Nesmeyanov N. A.Οι απαρχές της οργανικής χημείας. Σε 2 τόμους. - 2η έκδ., μετάφρ. - M.: “Chemistry”, 1974. - T. 1. - 624 p.
Ίδρυμα Wikimedia. 2010.
Δείτε τι είναι το "Silver Mirror Reaction" σε άλλα λεξικά:
Καθρέφτες - αποκτήστε ένα εκπτωτικό κουπόνι Angstrem στο Akademika ή αγοράστε κερδοφόρους καθρέφτες με δωρεάν παράδοση σε έκπτωση στο Angstrem
Δοκιμή με αντιδραστήριο Tollens. Αριστερά είναι ένα θετικό τεστ (αντίδραση με αλδεΰδη). Στα δεξιά υπάρχει αρνητικό τεστ (αντίδραση με κετόνη) Αντιδραστήριο Tollens (υδροξείδιο της διαμίνης αργύρου) αλκαλικό διάλυμα αμμωνίας αργύρου ΟΗ. Όταν... ... Wikipedia
- (από το λατινικό αλκοόλ dehydrogenatum αλκοόλη χωρίς υδρογόνο) μια κατηγορία οργανικών ενώσεων, με ... Wikipedia
Ov; pl. (μονάδες αλδεΰδης, α; m.). [διεστραμμένος λατ. al(cohol) dehyd(rogenatum) αλκοόλη χωρίς υδρογόνο]. Chem. Οργανικές ενώσεις, το προϊόν αφυδρογόνωσης πρωτοταγών αλκοολών (που χρησιμοποιούνται για την παραγωγή πολυμερών ή την οργανική σύνθεση κ.λπ.).... ... εγκυκλοπαιδικό λεξικό
Α. ΜΟΝΟΛΕΙΤΟΥΡΓΙΚΕΣ ΕΝΩΣΕΙΣ 1. Γ1: οργανομεταλλικές ενώσεις. Αυτές οι ενώσεις συνήθως παρασκευάζονται με δύο μεθόδους: α) με τη δράση ενός ενεργού μετάλλου (Na, Li, Mg, Zn) σε ένα οργανικό αλογονίδιο, για παράδειγμα: ή β) με τη δράση ενός αλογονιδίου λιγότερο... .. . Εγκυκλοπαίδεια Collier
Πολυμερές- (Πολυμερές) Ορισμός πολυμερούς, τύποι πολυμερισμού, συνθετικά πολυμερή Πληροφορίες σχετικά με τον ορισμό του πολυμερούς, είδη πολυμερισμού, συνθετικά πολυμερή Περιεχόμενα Περιεχόμενα Ορισμός Ιστορικό υπόβαθρο Επιστήμη των τύπων πολυμερισμού ... ... Εγκυκλοπαίδεια Επενδυτών
Αυτό το άρθρο αφορά τη χημική ουσία. Για το προϊόν διατροφής, δείτε Ζάχαρη. Σακχαρόζη ... Βικιπαίδεια
I (χημικό, Γλυκερίνη Γαλλικά, γλυκερίνη Γερμανικά και Αγγλικά) C2H3O2 = C2H5(OH)2 που ανακαλύφθηκε το 1779 από τον Scheele, ο οποίος παρατήρησε ότι όταν το ελαιόλαδο βράζεται με λιθάργη, εκτός από το σοβά μολύβδου (σαπούνι μολύβδου, δηλ. αλάτι μολύβδου του λιπαρά οξέα), αποδεικνύεται περισσότερα... ...
Σακχαρόζη Γενική Συστηματική ονομασία a D glucopyranosyl b D fructofuranoside Χημικός τύπος ... Wikipedia
- (C, ατομικό βάρος 12) είναι ένα από τα στοιχεία που είναι ευρέως κατανεμημένα στη φύση. Όντας μέρος φυτικών και ζωικών ιστών (μαζί με το υδρογόνο, το οξυγόνο και το άζωτο), το U παίζει σημαντικό ρόλο σε όλες τις διαδικασίες της ζωής... ... Εγκυκλοπαιδικό Λεξικό F.A. Brockhaus και I.A. Έφρων
Ασήμι- (Ασημί) Ορισμός αργύρου, εξόρυξη αργύρου, ιδιότητες ασημιού Πληροφορίες για τον ορισμό του αργύρου, εξόρυξη αργύρου, ιδιότητες ασημιού Περιεχόμενα Περιεχόμενα Ιστορία Ανακάλυψη. Εξαγωγή Ονόματα από τη λέξη Πιθανή έλλειψη αργύρου και ανάπτυξη Ιστορία του τραπεζιού ... Εγκυκλοπαίδεια Επενδυτών
Το πείραμα με το όμορφο αποτέλεσμα του σχηματισμού μιας επικάλυψης καθρέφτη στο γυαλί είναι πολύ οπτικό. Αυτή η αντίδραση απαιτεί εμπειρία και υπομονή. Σε αυτό το άρθρο θα μάθετε για την απαραίτητη και συγκεκριμένη προετοιμασία του εξοπλισμού και επίσης θα δείτε ποιες εξισώσεις αντίδρασης λαμβάνει χώρα αυτή η διαδικασία.
Η ουσία της αντίδρασης καθρέφτη αργύρου είναι ο σχηματισμός μεταλλικού αργύρου ως αποτέλεσμα μιας αντίδρασης οξειδοαναγωγής κατά την αλληλεπίδραση ενός διαλύματος αμμωνίας οξειδίου του αργύρου παρουσία αλδεΰδων.
"Silver Mirror" (δοκιμαστικός σωλήνας στα αριστερά)Για να δημιουργήσετε ένα ανθεκτικό στρώμα αργύρου θα χρειαστείτε:
- γυάλινη φιάλη χωρητικότητας έως 100 ml.
- διάλυμα αμμωνίας (2,5-4%).
- νιτρικός άργυρος (2%);
- υδατικό διάλυμα φορμαλδεΰδης (40%).
Αντ 'αυτού, μπορείτε να πάρετε ένα έτοιμο αντιδραστήριο Tollens - ένα διάλυμα αμμωνίας οξειδίου του αργύρου. Για να το δημιουργήσετε, πρέπει να προσθέσετε 1 γραμμάριο νιτρικού αργύρου σε 10 σταγόνες νερό (αν το υγρό θα αποθηκευτεί για μεγάλο χρονικό διάστημα, πρέπει να το τοποθετήσετε σε σκοτεινό μέρος ή σε γυάλινο δοχείο με σκούρα τοιχώματα). Αμέσως πριν από το πείραμα, το διάλυμα (περίπου 3 ml) πρέπει να αναμιχθεί σε αναλογία 1:1 με υδατικό διάλυμα υδροξειδίου του νατρίου 10%. Ο άργυρος μπορεί να κατακρημνιστεί, επομένως αραιώνεται με αργή προσθήκη διαλύματος αμμωνίας. Συνιστούμε να πραγματοποιήσετε ένα άλλο θεαματικό πείραμα με διάλυμα αμμωνίας και να εκτυπώσετε μια «χημική φωτογραφία».
Η αντίδραση διεξάγεται σε θερμοκρασία δωματίου. Απαραίτητη προϋπόθεση για έναν επιτυχημένο τελικό είναι τα απόλυτα καθαρά και λεία τοιχώματα του γυάλινου δοχείου. Εάν υπάρχουν τα παραμικρά σωματίδια ρύπων στους τοίχους, το ίζημα που λαμβάνεται ως αποτέλεσμα του πειράματος θα γίνει ένα χαλαρό στρώμα μαύρου ή σκούρου γκρι χρώματος.
Για να καθαρίσετε τη φιάλη, πρέπει να χρησιμοποιήσετε διαφορετικούς τύπους αλκαλικών διαλυμάτων, οπότε για επεξεργασία, μπορείτε να πάρετε ένα διάλυμα, το οποίο μετά τον καθαρισμό πρέπει να ξεπλυθεί με απεσταγμένο νερό. Είναι απαραίτητο να ξεπλύνετε τη φιάλη του καθαριστικού πολλές φορές.
Γιατί είναι τόσο σημαντική η καθαριότητα του σκάφους;
Το γεγονός είναι ότι τα κολλοειδή σωματίδια αργύρου που σχηματίζονται στο τέλος του πειράματος πρέπει να προσκολλώνται σταθερά στην επιφάνεια του γυαλιού. Δεν πρέπει να υπάρχουν λίπη ή μηχανικά σωματίδια στην επιφάνειά του. το νερό δεν περιέχει άλατα και είναι ιδανικό για τον τελικό καθαρισμό της φιάλης. Μπορεί να παρασκευαστεί στο σπίτι, αλλά είναι πιο εύκολο να αγοράσετε έτοιμο υγρό.
Εξίσωση αντίδρασης καθρέφτη αργύρου:
Ag2O + 4 NH3·Н2О ⇄ 2ОН + 3Н2О,
όπου το ΟΗ είναι το διαμίνη υδροξείδιο του αργύρου, που λαμβάνεται με τη διάλυση του οξειδίου του μετάλλου σε ένα υδατικό διάλυμα αμμωνίας.
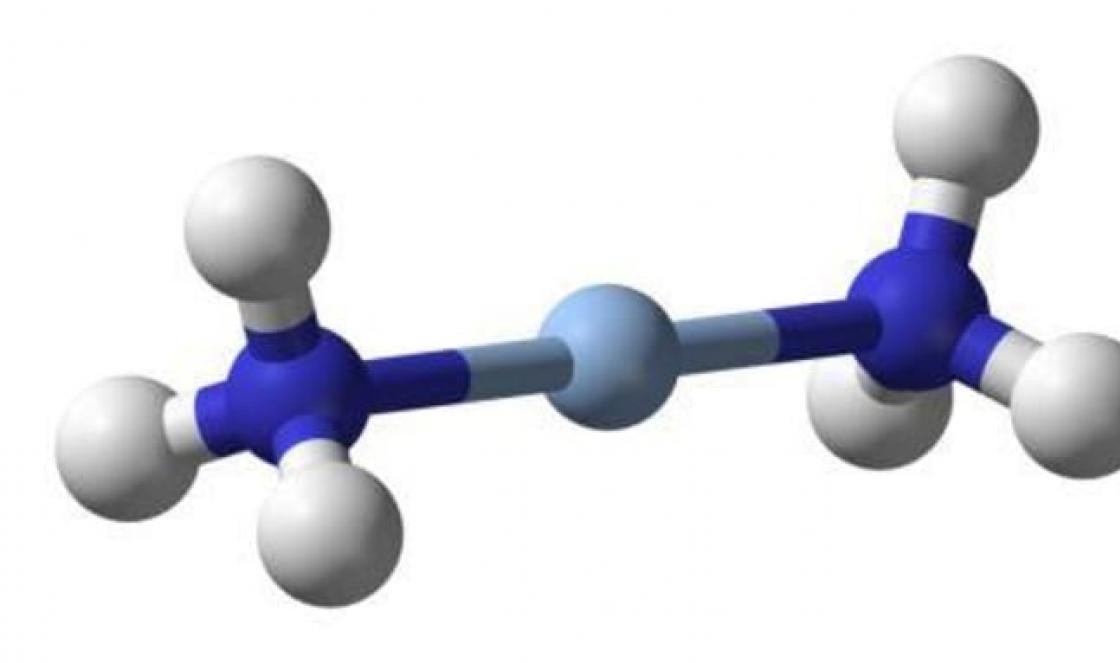
 Μόριο συμπλόκου διαμίνης αργύρου
Μόριο συμπλόκου διαμίνης αργύρου
Σπουδαίος!Η αντίδραση λειτουργεί σε χαμηλές συγκεντρώσεις αμμωνίας - παρατηρήστε προσεκτικά τις αναλογίες!
Έτσι προχωρά το τελικό στάδιο της αντίδρασης:
R (οποιαδήποτε αλδεΰδη)-CH=O + 2OH → 2Ag (κολλοειδές αργύρου που καταβυθίστηκε) ↓ + R-COONH4 + 3NH3 + H2O
Είναι καλύτερα να πραγματοποιήσετε το δεύτερο στάδιο της αντίδρασης θερμαίνοντας προσεκτικά τη φιάλη πάνω από τη φλόγα του καυστήρα - αυτό θα αυξήσει τις πιθανότητες επιτυχίας του πειράματος.
Τι μπορεί να δείξει η αντίδραση ενός ασημένιου καθρέφτη;
Αυτή η ενδιαφέρουσα χημική αντίδραση όχι μόνο δείχνει ορισμένες καταστάσεις μιας ουσίας - μπορεί να χρησιμοποιηθεί για τον ποιοτικό προσδιορισμό των αλδεΰδων. Δηλαδή, μια τέτοια αντίδραση θα λύσει το ερώτημα: αν υπάρχει ομάδα αλδεΰδης στο διάλυμα ή όχι.
 Γενικός δομικός τύπος αλδεΰδων
Γενικός δομικός τύπος αλδεΰδων
Για παράδειγμα, σε μια παρόμοια διαδικασία μπορείτε να μάθετε εάν ένα διάλυμα περιέχει γλυκόζη ή φρουκτόζη. Η γλυκόζη θα δώσει ένα θετικό αποτέλεσμα - θα πάρετε έναν "ασημένιο καθρέφτη", αλλά η φρουκτόζη περιέχει μια ομάδα κετόνης και είναι αδύνατο να ληφθεί ένα ίζημα αργύρου. Για να γίνει η ανάλυση, αντί για διάλυμα φορμαλδεΰδης, είναι απαραίτητο να προστεθεί διάλυμα γλυκόζης 10%. Ας δούμε γιατί και πώς το διαλυμένο ασήμι μετατρέπεται σε στερεό ίζημα:
2OH + 3H2O + C6H12O6 (γλυκόζη) = 2Ag6+ 4NH3∙H2O + C6H12O7 (σχηματίζεται γλυκονικό οξύ).
Ας ξεκινήσουμε με το γεγονός ότι κάθε κατηγορία οργανικών ουσιών έχει μια συγκεκριμένη αντίδραση με τη βοήθεια της οποίας οι εκπρόσωποί της μπορούν να διακριθούν από άλλες ουσίες. Το μάθημα της σχολικής χημείας περιλαμβάνει τη μελέτη όλων των αντιδραστηρίων υψηλής ποιότητας για τις κύριες κατηγορίες οργανικών ουσιών.
Αλδεΰδες: δομικά χαρακτηριστικά
Οι εκπρόσωποι αυτής της κατηγορίας είναι παράγωγα κορεσμένων υδρογονανθράκων στους οποίους η ρίζα συνδέεται με μια ομάδα αλδεΰδης. Οι κετόνες είναι ισομερή αλδεΰδων. Η ομοιότητά τους έγκειται στο ότι ανήκουν στην κατηγορία των καρβονυλικών ενώσεων. Κατά την εκτέλεση μιας εργασίας που περιλαμβάνει την απομόνωση μιας αλδεΰδης σε ένα μείγμα, θα απαιτηθεί μια αντίδραση «ασημένιου καθρέφτη». Ας αναλύσουμε τα χαρακτηριστικά αυτού του χημικού μετασχηματισμού, καθώς και τις συνθήκες για την υλοποίησή του. Η αντίδραση καθρέφτη αργύρου είναι η διαδικασία αναγωγής του μετάλλου αργύρου από υδροξείδιο της διαμίνης (1) αργύρου. Σε απλοποιημένη μορφή, είναι δυνατόν να γραφεί αυτή η σύνθετη ένωση στην απλοποιημένη μορφή του οξειδίου του αργύρου (1).
Διαχωρισμός ενώσεων καρβονυλίου
Για να σχηματιστεί μια σύνθετη ένωση, το οξείδιο του αργύρου διαλύεται σε αμμωνία. Λαμβάνοντας υπόψη ότι η διαδικασία είναι μια αναστρέψιμη αντίδραση, η αντίδραση καθρέφτη αργύρου πραγματοποιείται με ένα πρόσφατα παρασκευασμένο διάλυμα αμμωνίας οξειδίου του αργύρου (1). Όταν μια σύνθετη ένωση του argentum αναμιγνύεται με μια αλδεΰδη, εμφανίζεται μια αντίδραση οξειδοαναγωγής. Η ολοκλήρωση της διαδικασίας υποδεικνύεται από την καθίζηση μεταλλικού αργύρου. Όταν η αλληλεπίδραση αιθανάλης και διαλύματος αμμωνίας οξειδίου του αργύρου διεξάγεται σωστά, παρατηρείται ο σχηματισμός επικάλυψης αργύρου στα τοιχώματα του δοκιμαστικού σωλήνα. Ήταν το οπτικό αποτέλεσμα που έδωσε σε αυτήν την αλληλεπίδραση το όνομα «ασημένιος καθρέφτης».

Προσδιορισμός υδατανθράκων
Η αντίδραση ενός ασημένιου καθρέφτη είναι ποιοτική σε μια ομάδα αλδεΰδων, επομένως στα μαθήματα οργανικής χημείας αναφέρεται και ως τρόπος αναγνώρισης υδατανθράκων όπως η γλυκόζη. Λαμβάνοντας υπόψη την ειδική δομή αυτής της ουσίας, η οποία εμφανίζει τις ιδιότητες μιας αλδεΰδης-αλκοόλης, χάρη στην αντίδραση του «ασημένιου καθρέφτη», είναι δυνατή η διάκριση της γλυκόζης από τη φρουκτόζη.Έτσι, αυτή δεν είναι μόνο μια ποιοτική αντίδραση στις αλδεΰδες, αλλά και ένας τρόπος αναγνώρισης πολλών άλλων κατηγοριών οργανικών ουσιών.

Πρακτική εφαρμογή του «ασημένιου καθρέφτη»
Φαίνεται, ποιες δυσκολίες μπορεί να προκύψουν με την αλληλεπίδραση αλδεΰδων και διαλύματος αμμωνίας οξειδίου του αργύρου; Απλώς πρέπει να αγοράσετε οξείδιο του αργύρου, να αποθηκεύσετε αμμωνία και να επιλέξετε μια αλδεΰδη - και μπορείτε να ξεκινήσετε με ασφάλεια το πείραμα. Όμως μια τέτοια πρωτόγονη προσέγγιση δεν θα οδηγήσει τον ερευνητή στο επιθυμητό αποτέλεσμα. Αντί για την αναμενόμενη επιφάνεια καθρέφτη στα τοιχώματα του δοκιμαστικού σωλήνα, θα δείτε (στην καλύτερη περίπτωση) μια σκούρα καφέ ασημί ανάρτηση.

Η ουσία της αλληλεπίδρασης
Μια αντίδραση υψηλής ποιότητας στο ασήμι συνεπάγεται την τήρηση ενός συγκεκριμένου αλγόριθμου ενεργειών. Συχνά, ακόμη και όταν εμφανίζονται σημάδια ενός στρώματος καθρέφτη, η ποιότητά του αφήνει σαφώς πολλά να είναι επιθυμητά. Ποιοι είναι οι λόγοι για μια τέτοια αποτυχία; Είναι δυνατόν να τα αποφύγουμε; Μεταξύ των πολλών προβλημάτων που μπορούν να οδηγήσουν σε ανεπιθύμητα αποτελέσματα, υπάρχουν δύο βασικά:
- παραβίαση των συνθηκών για χημική αλληλεπίδραση ·
- κακή προετοιμασία της επιφάνειας για ασημοποίηση.
Κατά την αλληλεπίδραση των αρχικών ουσιών στο διάλυμα, σχηματίζονται κατιόντα αργύρου, τα οποία συνδυάζονται με την ομάδα αλδεΰδης, σχηματίζοντας τελικά κολλοειδή μικρά σωματίδια αργύρου. Αυτοί οι κόκκοι μπορούν να προσκολληθούν στο γυαλί, αλλά μπορούν να διατηρηθούν σε διάλυμα ως εναιώρημα αργύρου. Προκειμένου τα σωματίδια πολύτιμου μετάλλου να προσκολληθούν στο γυαλί και να σχηματιστεί ένα ομοιόμορφο και ανθεκτικό στρώμα, είναι σημαντικό να προηγηθεί η απολίπανση του γυαλιού. Μόνο εάν υπάρχει μια τέλεια καθαρή αρχική επιφάνεια του δοκιμαστικού σωλήνα μπορεί κανείς να υπολογίζει στο σχηματισμό ενός ομοιόμορφου στρώματος αργύρου.
Πιθανά προβλήματα
Ο κύριος ρύπος των γυάλινων σκευών είναι οι λιπαρές εναποθέσεις, οι οποίες πρέπει να αφαιρεθούν. Ένα αλκαλικό διάλυμα, καθώς και ένα ζεστό μείγμα χρωμίου, θα βοηθήσουν στην επίλυση του προβλήματος. Στη συνέχεια, ο δοκιμαστικός σωλήνας πλένεται με απεσταγμένο νερό. Εάν δεν υπάρχει αλκάλιο, μπορείτε να χρησιμοποιήσετε ένα συνθετικό απορρυπαντικό πιάτων. Αφού ολοκληρωθεί η απολίπανση, το ποτήρι πλένεται με διάλυμα χλωριούχου κασσίτερου και ξεπλένεται με νερό. Για την παρασκευή διαλυμάτων χρησιμοποιείται απεσταγμένο νερό. Εάν δεν είναι διαθέσιμο, μπορείτε να χρησιμοποιήσετε το νερό της βροχής. Η γλυκόζη και η φορμαλδεΰδη χρησιμοποιούνται ως αναγωγικοί παράγοντες που επιτρέπουν την καθίζηση μιας καθαρής ουσίας από ένα διάλυμα. Με την αλδεΰδη είναι δύσκολο να βασιστεί κανείς στην απόκτηση επικάλυψης αργύρου υψηλής ποιότητας, αλλά ένας μονοσακχαρίτης (γλυκόζη) δίνει ένα ομοιόμορφο και ανθεκτικό στρώμα αργύρου στην επιφάνεια του καθρέφτη.

συμπέρασμα
Για το ασήμι γυαλί, συνιστάται η χρήση νιτρικού αργύρου. Στο διάλυμα αυτού του άλατος προστίθενται διάλυμα αλκαλίου και αμμωνίας. Προϋπόθεση για πλήρη αντίδραση και εναπόθεση αργύρου στο γυαλί είναι η δημιουργία αλκαλικού περιβάλλοντος. Αλλά εάν υπάρχει περίσσεια αυτού του αντιδραστηρίου, είναι πιθανές παρενέργειες. Ανάλογα με την επιλεγμένη πειραματική τεχνική, επιτυγχάνεται μια αντίδραση υψηλής ποιότητας με θέρμανση. Ο καφές χρωματισμός του διαλύματος υποδηλώνει το σχηματισμό μικροσκοπικών κολλοειδών σωματιδίων αργύρου. Στη συνέχεια, εμφανίζεται μια επίστρωση καθρέφτη στην επιφάνεια του γυαλιού. Εάν η διαδικασία είναι επιτυχής, το μεταλλικό στρώμα θα είναι ομαλό και ανθεκτικό.
Η αντίδραση καθρέφτη αργύρου είναι ένα φανταχτερό όνομα για μια χημική αντίδραση που έχει ως αποτέλεσμα την καθίζηση ενός λεπτού στρώματος αργύρου στα τοιχώματα του δοχείου όπου έλαβε χώρα η διαδικασία. Μια φορά κι έναν καιρό, όλες οι επιφάνειες όπου χρειαζόταν επίστρωση καθρέφτη αντιμετωπίζονταν με αυτόν τον τρόπο.
Τώρα αυτή η μέθοδος απόκτησης μιας λεπτής απόθεσης μετάλλου σε γυαλί ή κεραμικά χρησιμοποιείται μόνο εάν είναι απαραίτητο να δημιουργηθεί ένα αγώγιμο στρώμα στα διηλεκτρικά, καθώς και στην παραγωγή οπτικών για τηλεσκόπια, κάμερες κ.λπ. Αυτή η αντίδραση μπορεί επίσης να χρησιμοποιηθεί για αποκτώ. Ένα τέτοιο ποιητικό όνομα για μια απλή χημική αντίδραση βασίζεται στον ενθουσιασμό που προκύπτει όταν πρόκειται για πολύτιμα μέταλλα - χρυσό και ασήμι.
Για να πραγματοποιηθεί η αναγωγή του αργύρου από το οξείδιο του όχι σε εργαστηριακές συνθήκες, είναι απαραίτητο να διαλυθεί το νιτρικό άργυρο σε νερό. Μπορείτε να το προμηθευτείτε στο φαρμακείο. Αυτό είναι ένα μολύβι λάπις. Είναι προτιμότερο να χρησιμοποιείτε απεσταγμένο νερό. Μπορείτε να το αποκτήσετε απλά συμπυκνώνοντας νερό που εξατμίζεται από ένα βραστήρα. Εάν προχωρήσουμε από ένα δοχείο μισού λίτρου, τότε σε αυτή την ποσότητα διαλύματος νιτρικού αργύρου είναι απαραίτητο να διαλυθεί αμμωνία (1 κουταλάκι του γλυκού). Εδώ πρέπει να προσθέσετε 2-3 σταγόνες φορμαλδεΰδης - φορμαλδεΰδης.
Όλα τα αντιδραστήρια δεν αντιδρούν αμέσως, γι' αυτό ανακινήστε καλά το διάλυμα και αφήστε το μόνο του για περίπου μία ημέρα. Εάν όλα πάνε καλά, τότε κατά τη διάρκεια αυτής της περιόδου το βάζο σας θα καλυφθεί με ένα λεπτό μεταλλικό στρώμα. Η ίδια στρώση θα καλύψει το αντικείμενο που τοποθετείτε στο βάζο.
Μερικές φορές κάτι πάει στραβά και αντί για καθρέφτη, η αντίδραση παράγει γκρίζες νιφάδες καθίζησης. Αυτό υποδηλώνει ότι τα αντιδραστήρια δεν ήταν εντελώς καθαρά. Τις περισσότερες φορές, θα πρέπει να γίνονται παράπονα για το νερό και την καθαριότητα των πιάτων. Ιδιαίτερη προσοχή πρέπει να δοθεί στην οξύτητα του νερού, καθώς οι περισσότερες εκπλήξεις συμβαίνουν σε αλκαλικό περιβάλλον.
Λειτουργία ένδειξης αντίδρασης
Χρησιμοποιώντας αυτή την αντίδραση, προσδιορίζεται η παρουσία αλδεΰδων σε ένα διάλυμα. Αυτή η ομάδα περιλαμβάνει οργανικές ουσίες που έχουν μια ομάδα αλδεΰδης. Διαφορετικά ονομάζονται αλκοόλες χωρίς υδρογόνο. Η παρουσία αλδεΰδης στο διάλυμα δίνει το φαινόμενο καθρέφτη.
Ένα διάλυμα αμμωνίας οξειδίου του αργύρου χρησιμοποιείται για τον προσδιορισμό μονοσακχαριτών και δισακχαριτών. Η πρώτη ομάδα περιλαμβάνει τη γλυκόζη σε όλες τις ισομερείς της καταστάσεις, η δεύτερη ομάδα περιλαμβάνει τη λακτόζη και τη μαλτόζη. Η αντίδραση του ασημένιου καθρέφτη είναι ιδιαίτερα χαρακτηριστική της γλυκόζης, η οποία αντανακλάται στις μεθόδους ανίχνευσης γλυκόζης και φρουκτόζης.
Παρά την ομοιότητα αυτών των ουσιών και το γεγονός ότι η φρουκτόζη είναι ισομερής προς τη γλυκόζη, εξακολουθούν να είναι διαφορετικές. Σε ανοιχτή μορφή, η ομάδα αλδεΰδης υπάρχει μόνο στη γλυκόζη. Κατά συνέπεια, ο άργυρος θα καθιζάνει μόνο παρουσία γλυκόζης, ενώ η φρουκτόζη δεν θα δώσει μια τέτοια αντίδραση. Αλλά σε ένα αλκαλικό περιβάλλον, η φρουκτόζη μπορεί να δώσει μια θετική αντίδραση.
Έτσι, το οξείδιο του αργύρου ως αντιδραστήριο μπορεί να χρησιμοποιηθεί ως δείκτης της παρουσίας μιας συγκεκριμένης ομάδας ουσιών σε ένα διάλυμα. Επιπλέον, με τη βοήθεια της περιγραφόμενης αντίδρασης μπορείτε να αποκτήσετε καθαρό ασήμι, έναν ασημένιο καθρέφτη και μια πλάκα επικαλυμμένη και στις δύο πλευρές με μεταλλική επίστρωση, η οποία δεν είναι μόνο διασκεδαστική, αλλά και συχνά χρήσιμη.
Συγγραφέας L.A. Tsvetkov
Αυτή η εμπειρία πρέπει να αποδεικνύεται στους μαθητές με τέτοιο τρόπο ώστε να χρησιμεύει ταυτόχρονα ως οδηγία για το επόμενο πρακτικό μάθημα. Η φύση του διαλύματος αμμωνίας του οξειδίου του αργύρου μπορεί να εξηγηθεί λεπτομερώς στους μαθητές, αλλά μπορείτε μόνο να τους ενημερώσετε ότι το υδροξείδιο του αργύρου που σχηματίζεται κατά την αντίδραση είναι μια εύθραυστη ουσία και διασπάται εύκολα σε οξείδιο του αργύρου και νερό:
AgNO 3 + NH 4 OH à AgOH + NH 4 NO 3
2 AgOH à Ag 2 O + H 2 O
Το οξείδιο του αργύρου έχει την ιδιότητα να διαλύεται στην αμμωνία
Ag 2 O + 4NH 4 OH à 2OH + H 2 O
Η οξειδωτική δράση του οξειδίου του αργύρου εξηγείται από το γεγονός ότι αυτή η ουσία είναι ένα οξείδιο ενός ευγενούς μετάλλου, επομένως το οξείδιο είναι ασταθές ακόμη και παρουσία ενός αναγωγικού παράγοντα, δηλ. ουσία που οξειδώνεται εύκολα, αποβάλλει εύκολα οξυγόνο, με αποτέλεσμα την απελευθέρωση (μείωση) μεταλλικού αργύρου. Η εξίσωση αντίδρασης μπορεί να δοθεί στη συνήθη μορφή:
HC-OH + Ag 2 O -> HCOOH + 2Ag
και μπορείτε να φανταστείτε την πλήρη εξίσωση αντίδρασης:
HC-OH + 2OH -> HCOOH + 2Ag + 4NH 3 + H 2 O
Ένας ασημένιος καθρέφτης σχηματίζεται όταν ο αναγωγικός άργυρος εναποτίθεται στα λεία τοιχώματα ενός δοχείου από όχι πολύ συμπυκνωμένα διαλύματα. Οι παραμικρές ακαθαρσίες εμποδίζουν το αναγωγικό ασήμι να «κολλήσει» στο γυαλί και να το κάνουν να καθιζάνει ως χαλαρό ίζημα. Η φύση της θέρμανσης έχει πολύ μικρότερη επίδραση στην επιτυχία του πειράματος. Εάν το δοχείο δεν είναι αρκετά καθαρό, τότε ακόμη και η πιο προσεκτική θέρμανση δεν θα δώσει έναν καθρέφτη και αντίστροφα, εάν το δοχείο προετοιμαστεί προσεκτικά, τότε ακόμη και η θέρμανση του μείγματος σε ανοιχτή φωτιά μπορεί να δώσει το επιθυμητό αποτέλεσμα.
Το πρώτο πείραμα για την απόκτηση ενός ασημένιου καθρέφτη θα πρέπει να πραγματοποιηθεί σε κώνο και όχι σε δοκιμαστικό σωλήνα. Πριν από το μάθημα, μια φιάλη χωρητικότητας 50-100 ml καθαρίζεται από μηχανικές ακαθαρσίες, πλένεται με μια βούρτσα με σαπουνόνερο ή ένα αλκαλικό διάλυμα θερμαίνεται στη φιάλη, στη συνέχεια ξεπλένεται με νερό, πλένεται με μείγμα χρωμίου και τέλος πλένεται πλήρως με απεσταγμένο νερό.
Ένα διάλυμα 2% νιτρικού αργύρου χύνεται στη φιάλη σε ένα τέταρτο του όγκου, στη συνέχεια προστίθεται σταδιακά ένα διάλυμα αμμωνίας (25% αμμωνία θα πρέπει να αραιωθεί 8-10 φορές) έως ότου το ίζημα που σχηματίζεται αρχικά να διαλυθεί στην περίσσεια του. Στο προκύπτον διάλυμα, προσθέστε προσεκτικά 0,5-1 ml φορμαλίνης κατά μήκος του τοιχώματος και τοποθετήστε τη φιάλη σε ένα ποτήρι ζεστό (κατά προτίμηση βραστό) νερό.
Σύντομα ένας όμορφος ασημένιος καθρέφτης θα σχηματιστεί στη φιάλη. Η φιάλη μπορεί να θερμανθεί χωρίς λουτρό νερού, απευθείας σε μικρή φλόγα, μετακινώντας τη φλόγα γύρω από τη φιάλη και χωρίς ανακίνηση. Κατά την επίδειξη ενός πειράματος, μερικές φορές σχηματίζεται ένα μαύρο ίζημα αντί για έναν ασημί καθρέφτη. Σε αυτή την περίπτωση, ο δάσκαλος συνήθως απορρίπτει εντελώς την εμπειρία. Εν τω μεταξύ, με αυτό το αποτέλεσμα, θα πρέπει να εξηγηθεί στους μαθητές ότι και εδώ η αναγωγή του αργύρου συνέβη μόνο με τη μορφή ενός χαλαρού μαύρου ιζήματος.